- ACIDO-BASIQUE (ÉQUILIBRE)
- ACIDO-BASIQUE (ÉQUILIBRE)C’est en 1922 que Van Slyke pose les premiers principes de l’équilibre acido-basique, en reprenant la définition du pH fournie en 1909 par Sœrensen (logarithme de l’inverse de la concentration en ions hydrogène). Il montre la constance de ce pH dans le milieu intérieur. Seules de faibles variations sont compatibles avec la vie; les limites extrêmes enregistrées chez l’homme atteignent 6,90 et 7,80, alors que le pH sanguin normal mesuré à 38 0C est de 7,39 梁 0,015. La constance de ce pH concerne non seulement le sang, mais également les autres humeurs (lymphe, liquide céphalorachidien, etc.) et le contenu cellulaire. Cependant le sang, par son accessibilité immédiate, reste le meilleur reflet du pH du milieu intérieur.Van Slyke a défini la réserve alcaline comme la quantité de gaz carbonique en centimètres cubes libérée par 100 millilitres de plasma en présence d’un acide fort. Cette valeur, si souvent utilisée, a été abandonnée au profit de la notion plus précise de gaz carbonique total, qui est maintenant préférée.L.-J. Henderson et Hasselbach fournirent des données théoriques en établissant l’équation de l’équilibre acido-basique. Puis les données s’accumulèrent: découverte de l’anhydrase carbonique par Roughton, Meldrum, Stady, O’Brien, et mise en évidence de son rôle dans le transport du gaz carbonique par Keilin et Mann; description de l’effet de migration ionique au niveau des globules rouges par Hamburger. Après une phase de mise en ordre des notions éparses (schémas physiopathologiques de Davenport et Astrup), c’est l’étape moderne, essentielle, riche de promesses: la mesure des pH intracellulaires mise au point par Waddel et Butler en 1959.L’étude de l’équilibre acido-basique comporte plusieurs centres d’intérêt: établissement du bilan entrées-sorties des ions hydrogène H+, mise en évidence des systèmes permettant d’amortir de faibles variations de ce bilan, rôle des mécanismes physiologiques qui complètent l’action de ces systèmes, et enfin schématisation des perturbations pathologiques de l’équilibre acido-basique.1. Le bilan des ions hydrogène H+Les entrées sont constituées par les apports alimentaires et métaboliques.L’apport alimentaire en ions hydrogène H+ est essentiellement représenté par les amino-acides introduits par les protéines (10 g de protéines libèrent 6 à 7 milliéquivalents d’ions H+).Le métabolisme cellulaire est également une source d’ions H+: acides cétoniques, acide lactique, et surtout acide carbonique, terme ultime du métabolisme.Les sorties sont assurées par deux émonctoires: le rein, qui permet l’élimination d’ions H+ liés à des anions non volatils, et le poumon qui, lui, ne peut intervenir que sur les ions H+ liés à l’anion volatil bicarbonate, l’élimination s’effectuant sous forme de gaz carbonique et d’eau.Physiologiquement, il y a équilibre entre les entrées et les sorties, et le pH des liquides de l’organisme reste pratiquement constant.2. Les systèmes tamponsOn appelle tampons des substances qui, lorsqu’elles sont présentes dans une solution, maintiennent celle-ci à un pH relativement constant, quand un acide ou une base y sont ajoutés.Les systèmes tampons biologiques sont de deux types: extracellulaire et intracellulaire.Systèmes extracellulairesLes systèmes extracellulaires sont essentiellement plasmatiques (les phénomènes, quoique moins bien connus, semblent être du même ordre dans le tissu interstitiel); l’un est essentiel, c’est le système acide carbonique-bicarbonate, deux autres sont plus accessoires: système phosphate monosodique-phosphate disodique, et système protéine-protéinate.Le système acide carbonique-bicarbonateLe plasma contient, à l’état normal, 1,65 g/l de bicarbonate, et 0,085 g/l d’acide carbonique (correspondant à 0,060 g/l de gaz carbonique dissous). Il existe un équilibre, défini par l’équation:
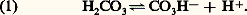 En fait, l’acide carbonique est très faiblement dissocié, et les ions C3H- sont à peu près exclusivement ceux des bicarbonates. L’application de la loi d’action de masse à l’équation d’équilibre fournit:
En fait, l’acide carbonique est très faiblement dissocié, et les ions C3H- sont à peu près exclusivement ceux des bicarbonates. L’application de la loi d’action de masse à l’équation d’équilibre fournit: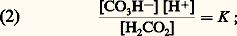 [C3H-], [H2C3], [H+] désignent respectivement les concentrations en ions bicarbonates, acide carbonique non dissocié, ions hydrogène, et K la constante de dissociation du premier hydrogène de l’acide carbonique.L’équation (2) peut s’écrire:
[C3H-], [H2C3], [H+] désignent respectivement les concentrations en ions bicarbonates, acide carbonique non dissocié, ions hydrogène, et K la constante de dissociation du premier hydrogène de l’acide carbonique.L’équation (2) peut s’écrire: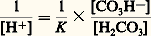 ou en notation logarithmique:
ou en notation logarithmique: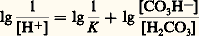 ou en notation de Sœrensen:
ou en notation de Sœrensen: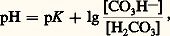 que l’on écrit souvent (équation d’Henderson-Hasselbach):
que l’on écrit souvent (équation d’Henderson-Hasselbach):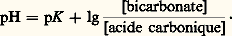 Le pK (correspondant à la constante de dissociation du premier hydrogène de l’acide carbonique) étant de 6,10, et le rapport bicarbonate/acide carbonique (mesuré dans des conditions physiologiques) de 20, le pH sanguin calculé est de 6,10 + lg 20 = 7,40, ce qui correspond bien aux valeurs mesurées expérimentalement pour le sang artériel.Le système phosphate monosodique-phosphate disodiqueComme précédemment, on obtient, à partir de l’équation d’équilibre:
Le pK (correspondant à la constante de dissociation du premier hydrogène de l’acide carbonique) étant de 6,10, et le rapport bicarbonate/acide carbonique (mesuré dans des conditions physiologiques) de 20, le pH sanguin calculé est de 6,10 + lg 20 = 7,40, ce qui correspond bien aux valeurs mesurées expérimentalement pour le sang artériel.Le système phosphate monosodique-phosphate disodiqueComme précédemment, on obtient, à partir de l’équation d’équilibre: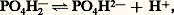 l’équation:
l’équation: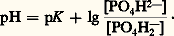 Le pK correspondant à la constante de dissociation du deuxième hydrogène de l’acide phosphorique est de 6,82 et le rapport:
Le pK correspondant à la constante de dissociation du deuxième hydrogène de l’acide phosphorique est de 6,82 et le rapport: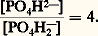 Ce système est théoriquement plus efficace que le système bicarbonate-acide carbonique, car le phosphate monosodique est un acide plus faible que l’acide carbonique; en fait, il ne constitue biologiquement qu’un facteur accessoire, car il n’existe que peu de phosphates dans le plasma (2 milliéquivalents par litre).Le système protéine-protéinateMalgré sa faible efficacité théorique, le système protéine-protéinate joue un rôle non négligeable, en raison de l’importante concentration plasmatique en protéines (75 g/l), soit 18 mEq/l (milliéquivalents par litre).Systèmes intracellulairesLes systèmes intracellulaires sont de deux types: érythrocytaire (globules rouges) et extra-érythrocytaire.Le système érythrocytaireLe système érythrocytaire est constitué par l’ensemble hémoglobine-oxyhémoglobine qui, pour le pH sanguin normal, jouent le rôle d’acides faibles. Cependant, la constante de dissociation de l’oxyhémoglobine est supérieure à celle de l’hémoglobine, ce qui revient à dire que l’oxyhémoglobine est un acide plus fort que l’hémoglobine; elle libère donc des bases lors de sa transformation en hémoglobine dans les tissus. C’est justement à ce moment que le taux d’acide carbonique s’accroît à l’intérieur des érythrocytes; les bases ainsi libérées donneront sur place des bicarbonates. L’accroissement d’acidité dû à l’augmentation d’acide carbonique est ainsi compensé non seulement par cette libération des bases, mais aussi par la diminution d’acidité due à la transformation de l’oxyhémoglobine en hémoglobine. Il existe donc, dans l’érythrocyte, deux systèmes tampons solidaires: hémoglobine-hémoglobinate, et surtout oxyhémoglobine-oxyhémoglobinate.Le système extra-érythrocytaireLe système extra-érythrocytaire est connu: il comporte l’ensemble des tampons cellulaires, vraisemblablement formé par des protéinates. Le squelette lui-même constitue un système tampon: il peut échanger une partie de ses ions sodium, avec des ions hydrogène lors d’une acidose et inversement lors d’une alcalose. L’importance des sytèmes extra-érythrocytaires, sur le plan quantitatif, était encore méconnue jusqu’aux travaux utilisant les méthodes isotopiques et la diffusion d’un acide organique faible (le DMO ou acide diméthyl-5,5 dione-2,4 oxazolidine) permettant la mesure du pH intracellulaire. La paroi cellulaire n’étant perméable qu’à la forme non dissociée de l’acide, la comparaison des concentrations des formes dissociées et non dissociées de l’acide, de part et d’autre de la membrane cellulaire, permet une détermination du pH intracellulaire. La valeur expérimentale obtenue 6,94 n’est qu’une moyenne de l’ensemble des pH cellulaires réels.3. Évaluation de l’équilibre acido-basiqueToutes les déterminations sont effectuées sur le plasma vrai, c’est-à-dire celui qui a été séparé des éléments figurés par centrifugation dans des conditions strictement anaérobies.L’acide carbonique existe en fait sous forme de C2 dissous (moins de 1 p. 100 étant sous forme de H2C3). On désigne donc sous le terme de C2 dissous la somme H2C3 + C2 définie par l’expression S 憐 pC2 où S est le coefficient qui relie la somme H2C3 + C2 en mmol/l à la pression partielle p du C2 en mmHg (ou torr). Cette pression est celle de la phase gazeuse en équilibre avec le liquide biologique. Le coefficient S varie avec la température (il est de 0,0301 à 37 0C).Dans sa définition physiologique, la concentration en bicarbonates comprend non seulement les ions bicarbonates, mais aussi les ions carbonates: l’erreur introduite par cette approximation est faible, pour ce qui est du plasma et du liquide extracellulaire, mais elle est importante pour ce qui est du liquide intracellulaire. En pratique courante, on obtient la concentration en bicarbonates grâce à la relation:
Ce système est théoriquement plus efficace que le système bicarbonate-acide carbonique, car le phosphate monosodique est un acide plus faible que l’acide carbonique; en fait, il ne constitue biologiquement qu’un facteur accessoire, car il n’existe que peu de phosphates dans le plasma (2 milliéquivalents par litre).Le système protéine-protéinateMalgré sa faible efficacité théorique, le système protéine-protéinate joue un rôle non négligeable, en raison de l’importante concentration plasmatique en protéines (75 g/l), soit 18 mEq/l (milliéquivalents par litre).Systèmes intracellulairesLes systèmes intracellulaires sont de deux types: érythrocytaire (globules rouges) et extra-érythrocytaire.Le système érythrocytaireLe système érythrocytaire est constitué par l’ensemble hémoglobine-oxyhémoglobine qui, pour le pH sanguin normal, jouent le rôle d’acides faibles. Cependant, la constante de dissociation de l’oxyhémoglobine est supérieure à celle de l’hémoglobine, ce qui revient à dire que l’oxyhémoglobine est un acide plus fort que l’hémoglobine; elle libère donc des bases lors de sa transformation en hémoglobine dans les tissus. C’est justement à ce moment que le taux d’acide carbonique s’accroît à l’intérieur des érythrocytes; les bases ainsi libérées donneront sur place des bicarbonates. L’accroissement d’acidité dû à l’augmentation d’acide carbonique est ainsi compensé non seulement par cette libération des bases, mais aussi par la diminution d’acidité due à la transformation de l’oxyhémoglobine en hémoglobine. Il existe donc, dans l’érythrocyte, deux systèmes tampons solidaires: hémoglobine-hémoglobinate, et surtout oxyhémoglobine-oxyhémoglobinate.Le système extra-érythrocytaireLe système extra-érythrocytaire est connu: il comporte l’ensemble des tampons cellulaires, vraisemblablement formé par des protéinates. Le squelette lui-même constitue un système tampon: il peut échanger une partie de ses ions sodium, avec des ions hydrogène lors d’une acidose et inversement lors d’une alcalose. L’importance des sytèmes extra-érythrocytaires, sur le plan quantitatif, était encore méconnue jusqu’aux travaux utilisant les méthodes isotopiques et la diffusion d’un acide organique faible (le DMO ou acide diméthyl-5,5 dione-2,4 oxazolidine) permettant la mesure du pH intracellulaire. La paroi cellulaire n’étant perméable qu’à la forme non dissociée de l’acide, la comparaison des concentrations des formes dissociées et non dissociées de l’acide, de part et d’autre de la membrane cellulaire, permet une détermination du pH intracellulaire. La valeur expérimentale obtenue 6,94 n’est qu’une moyenne de l’ensemble des pH cellulaires réels.3. Évaluation de l’équilibre acido-basiqueToutes les déterminations sont effectuées sur le plasma vrai, c’est-à-dire celui qui a été séparé des éléments figurés par centrifugation dans des conditions strictement anaérobies.L’acide carbonique existe en fait sous forme de C2 dissous (moins de 1 p. 100 étant sous forme de H2C3). On désigne donc sous le terme de C2 dissous la somme H2C3 + C2 définie par l’expression S 憐 pC2 où S est le coefficient qui relie la somme H2C3 + C2 en mmol/l à la pression partielle p du C2 en mmHg (ou torr). Cette pression est celle de la phase gazeuse en équilibre avec le liquide biologique. Le coefficient S varie avec la température (il est de 0,0301 à 37 0C).Dans sa définition physiologique, la concentration en bicarbonates comprend non seulement les ions bicarbonates, mais aussi les ions carbonates: l’erreur introduite par cette approximation est faible, pour ce qui est du plasma et du liquide extracellulaire, mais elle est importante pour ce qui est du liquide intracellulaire. En pratique courante, on obtient la concentration en bicarbonates grâce à la relation: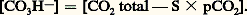 Le C2 total représente la quantité de C2 pouvant être extraite du plasma, en présence d’un acide fort: on l’exprime en volumes de C2 libérés par 100 ml de plasma, ou mieux, en mmol/l. La forme pratique d’utilisation de l’équation d’Henderson-Hasselbach est alors:
Le C2 total représente la quantité de C2 pouvant être extraite du plasma, en présence d’un acide fort: on l’exprime en volumes de C2 libérés par 100 ml de plasma, ou mieux, en mmol/l. La forme pratique d’utilisation de l’équation d’Henderson-Hasselbach est alors: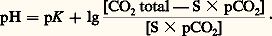 Il existe donc trois méthodes de détermination de l’équilibre acido-basique sanguin:– mesures du pH et du C2 total plasmatique, la pC2 étant dans ce cas obtenue par calcul;– mesures du pH et de la pC2, le C2 total plasmatique étant alors calculé;– mesures du C2 total plasmatique et de la pC2, le pH étant déterminé indirectement.On peut y ajouter la méthode d’interpolation d’Astrup, qui utilise trois mesures de pH: l’un réel, les deux autres sous des pressions de C2 connues, différentes.Chez l’adulte normal, on détermine ainsi:
Il existe donc trois méthodes de détermination de l’équilibre acido-basique sanguin:– mesures du pH et du C2 total plasmatique, la pC2 étant dans ce cas obtenue par calcul;– mesures du pH et de la pC2, le C2 total plasmatique étant alors calculé;– mesures du C2 total plasmatique et de la pC2, le pH étant déterminé indirectement.On peut y ajouter la méthode d’interpolation d’Astrup, qui utilise trois mesures de pH: l’un réel, les deux autres sous des pressions de C2 connues, différentes.Chez l’adulte normal, on détermine ainsi: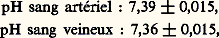
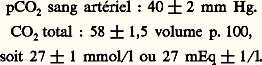 4. La régulation de l’équilibreLa régulation de l’équilibre s’effectue dans l’immédiat par l’intervention des systèmes tampons, à court terme par le poumon, à long terme par le rein.Le poumon , en excrétant par les voies respiratoires du gaz carbonique, modifie la pC2 du sang artériel.Or, la régulation de la ventilation pulmonaire dépend de deux stimuli: la pCO2 artérielle et le pH du sang artériel. Par mécanisme réflexe, grâce à l’intermédiaire des dispositifs sensibles (chémorécepteurs aortiques et carotidiens), toute élévation de la pC2 artérielle, ou hypercapnie, stimule les centres respiratoires bulbaires, d’où hyperventilation qui tend à corriger le trouble initial. Inversement, l’hypocapnie provoque une hypoventilation, mais ce mécanisme est toujours limité par l’anoxie (diminution de la pCO2 artérielle) qu’il crée. En effet, les centres bulbaires sensibles à l’anoxie y répondent par une hyperventilation.Les variations de pH artériel provoquent des perturbations ventilatoires: ainsi l’injection intraveineuse rapide d’une solution acide provoque-t-elle une hyperventilation, alors qu’une solution alcaline provoquerait une hypoventilation.Le mécanisme d’action est discuté: soit réflexe, par l’intermédiaire des chémorécepteurs aortiques et carotidiens, soit par variations du pH intracellulaire, capable de modifier directement l’activité des centres nerveux, soit enfin, pour certains, par variation du pH du liquide céphalo-rachidien.Il est souvent difficile de dissocier les parts respectives des variations de pC2 et de pH artériels dans les modifications ventilatoires.Le tubule rénal contribue au maintien de l’équilibre acido-basique par trois mécanismes: excrétion ou réabsorption des bicarbonates, excrétion d’acides faibles et formation de sels d’ammonium (cf. figure).L’excrétion des bicarbonates est normalement inférieure à 2 mEq (168 mg) par jour; elle s’annule quand le pH urinaire s’abaisse au-dessous de 6, elle augmente considérablement lorsqu’il dépasse 7. En fait, ces variations dépendent de l’intensité de la réabsorption tubulaire des bicarbonates qui s’élève lors d’une augmentation de la pC2 artérielle, et diminue lors d’une diminution de cette pC2. Ces échanges sont rendus possibles par la présence d’une enzyme, l’anhydrase carbonique, qui assure dans la cellule tubulaire la transformation:
4. La régulation de l’équilibreLa régulation de l’équilibre s’effectue dans l’immédiat par l’intervention des systèmes tampons, à court terme par le poumon, à long terme par le rein.Le poumon , en excrétant par les voies respiratoires du gaz carbonique, modifie la pC2 du sang artériel.Or, la régulation de la ventilation pulmonaire dépend de deux stimuli: la pCO2 artérielle et le pH du sang artériel. Par mécanisme réflexe, grâce à l’intermédiaire des dispositifs sensibles (chémorécepteurs aortiques et carotidiens), toute élévation de la pC2 artérielle, ou hypercapnie, stimule les centres respiratoires bulbaires, d’où hyperventilation qui tend à corriger le trouble initial. Inversement, l’hypocapnie provoque une hypoventilation, mais ce mécanisme est toujours limité par l’anoxie (diminution de la pCO2 artérielle) qu’il crée. En effet, les centres bulbaires sensibles à l’anoxie y répondent par une hyperventilation.Les variations de pH artériel provoquent des perturbations ventilatoires: ainsi l’injection intraveineuse rapide d’une solution acide provoque-t-elle une hyperventilation, alors qu’une solution alcaline provoquerait une hypoventilation.Le mécanisme d’action est discuté: soit réflexe, par l’intermédiaire des chémorécepteurs aortiques et carotidiens, soit par variations du pH intracellulaire, capable de modifier directement l’activité des centres nerveux, soit enfin, pour certains, par variation du pH du liquide céphalo-rachidien.Il est souvent difficile de dissocier les parts respectives des variations de pC2 et de pH artériels dans les modifications ventilatoires.Le tubule rénal contribue au maintien de l’équilibre acido-basique par trois mécanismes: excrétion ou réabsorption des bicarbonates, excrétion d’acides faibles et formation de sels d’ammonium (cf. figure).L’excrétion des bicarbonates est normalement inférieure à 2 mEq (168 mg) par jour; elle s’annule quand le pH urinaire s’abaisse au-dessous de 6, elle augmente considérablement lorsqu’il dépasse 7. En fait, ces variations dépendent de l’intensité de la réabsorption tubulaire des bicarbonates qui s’élève lors d’une augmentation de la pC2 artérielle, et diminue lors d’une diminution de cette pC2. Ces échanges sont rendus possibles par la présence d’une enzyme, l’anhydrase carbonique, qui assure dans la cellule tubulaire la transformation: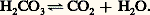 L’inhibition de cette enzyme par l’acétazolamide accroît l’élimination urinaire des bicarbonates. L’excrétion d’acides faibles constitue l’acidité titrable, qui se définit par la quantité de soude décinormale nécessaire pour ramener le pH urinaire au pH plasmatique: 20 à 30 mEq/24 heures; elle est constituée essentiellement par la transformation du phosphate disodique du filtrat glomérulaire en phosphate monosodique (cf. figure). Un ion sodium est ainsi récupéré par la cellule tubulaire, et fait retour au plasma, sous forme de bicarbonate de soude, en même temps qu’un ion hydrogène, fourni par la cellule tubulaire, vient remplacer cet ion sodium.La formation de sels d’ammonium contribue à l’élimination urinaire d’ions hydrogène. Sous l’action d’une glutaminase (cf. figure), la glutamine est scindée dans la cellule tubulaire, en acide glutamique et ammoniac. Un ion hydrogène, fourni par la cellule tubulaire, forme, avec ce dernier, un cation ammonium (NH4)+ qui prend la place d’un cation sodium, fourni par le filtrat glomérulaire. L’ion sodium est récupéré par l’organisme sous forme de bicarbonate, pendant que le cation ammonium est excrété sous forme de chlorure d’ammonium. (L’excrétion journalière moyenne, exprimée en azote, est de 0,4 à 1 g.)5. Les perturbationsOn classe les perturbations en acidose ou alcalose, suivant qu’existe une tendance à la baisse ou à la hausse du pH artériel. Si la perturbation initiale porte sur le paramètre bicarbonate de l’équation d’Henderson-Hasselbach, on parle d’acidose ou d’alcalose métabolique; inversement si le trouble initial porte sur la pC2, on parle d’acidose ou d’alcalose gazeuse.L’acidose métabolique est due à une perte de bases, donc de bicarbonates qui leur sont liés (par exemple: diarrhée, tubulopathie, traitement prolongé par inhibiteurs de l’anhydrase carbonique). Elle peut être due également à un excès d’acides non volatils, qui déplacent les bicarbonates, afin de conserver l’égalité anions-cations dans le milieu intérieur (par exemple: acidose diabétique par accumulation d’acides cétoniques, insuffisance rénale).Le mécanisme compensateur qui intervient est pulmonaire: hyperventilation, qui tend à abaisser la pC2 de façon à ramener:
L’inhibition de cette enzyme par l’acétazolamide accroît l’élimination urinaire des bicarbonates. L’excrétion d’acides faibles constitue l’acidité titrable, qui se définit par la quantité de soude décinormale nécessaire pour ramener le pH urinaire au pH plasmatique: 20 à 30 mEq/24 heures; elle est constituée essentiellement par la transformation du phosphate disodique du filtrat glomérulaire en phosphate monosodique (cf. figure). Un ion sodium est ainsi récupéré par la cellule tubulaire, et fait retour au plasma, sous forme de bicarbonate de soude, en même temps qu’un ion hydrogène, fourni par la cellule tubulaire, vient remplacer cet ion sodium.La formation de sels d’ammonium contribue à l’élimination urinaire d’ions hydrogène. Sous l’action d’une glutaminase (cf. figure), la glutamine est scindée dans la cellule tubulaire, en acide glutamique et ammoniac. Un ion hydrogène, fourni par la cellule tubulaire, forme, avec ce dernier, un cation ammonium (NH4)+ qui prend la place d’un cation sodium, fourni par le filtrat glomérulaire. L’ion sodium est récupéré par l’organisme sous forme de bicarbonate, pendant que le cation ammonium est excrété sous forme de chlorure d’ammonium. (L’excrétion journalière moyenne, exprimée en azote, est de 0,4 à 1 g.)5. Les perturbationsOn classe les perturbations en acidose ou alcalose, suivant qu’existe une tendance à la baisse ou à la hausse du pH artériel. Si la perturbation initiale porte sur le paramètre bicarbonate de l’équation d’Henderson-Hasselbach, on parle d’acidose ou d’alcalose métabolique; inversement si le trouble initial porte sur la pC2, on parle d’acidose ou d’alcalose gazeuse.L’acidose métabolique est due à une perte de bases, donc de bicarbonates qui leur sont liés (par exemple: diarrhée, tubulopathie, traitement prolongé par inhibiteurs de l’anhydrase carbonique). Elle peut être due également à un excès d’acides non volatils, qui déplacent les bicarbonates, afin de conserver l’égalité anions-cations dans le milieu intérieur (par exemple: acidose diabétique par accumulation d’acides cétoniques, insuffisance rénale).Le mécanisme compensateur qui intervient est pulmonaire: hyperventilation, qui tend à abaisser la pC2 de façon à ramener: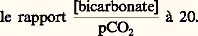 L’alcalose métabolique est due à un excès de bases (exemple: surdosage lors d’un traitement bicarbonaté) ou une perte d’acide (exemples: vomissements, carence potassique, élévation anormale du taux d’aldostérone sanguin).Le mécanisme compensateur est également pulmonaire par hypoventilation, qui tend à augmenter la pC2 artérielle: en fait, ce mécanisme est limité par l’anoxie qu’il provoque, entraînant une hyperventilation. La décompensation est donc plus rapide dans ce type de trouble.L’acidose gazeuse est provoquée par une élévation de la pC2 artérielle dont le type est l’hypercapnie aiguë, par dépression des centres respiratoires, mais aussi par obstruction des voies aériennes ou paralysie des muscles respiratoires (poliomyélite). La correction du trouble est rénale, par accroissement de la réabsorption des bicarbonates, de l’excrétion d’acidité titrable, de l’excrétion d’ions ammonium.L’alcalose gazeuse résulte d’une diminution de la pC2 artérielle par hyperventilation (exemples: anoxie des centres bulbaires, hypoxie par intoxication à l’oxyde de carbone, abaissement de la pC2 alvéolaire dans le séjour en altitude élevée). La correction est rénale par diminution de la réabsorption rénale des bicarbonates, de l’excrétion d’acidité titrable, de l’excrétion d’ions ammonium.En fait, les troubles mixtes sont extrêmement fréquents (exemples: insuffisance rénale chez un insuffisant respiratoire chronique, troubles respiratoires aigus chez les insuffisants rénaux). Dans tous les cas, les mécanismes compensateurs peuvent être vite débordés, les modifications du pH devenant patentes, voire mortelles, si elles dépassent les limites compatibles avec le maintien de la vie cellulaire.Un fait doit être souligné: il existe une tendance physiologique à l’acidose métabolique par accumulation d’acides non volatils, produits du métabolisme intermédiaire.Le rôle des tampons cellulaires commence à être entrevu: l’utilisation des mesures de pH cellulaire, associée à l’emploi des isotopes radioactifs pour la détermination des compartiments corporels, permettra de mieux comprendre leur rôle.
L’alcalose métabolique est due à un excès de bases (exemple: surdosage lors d’un traitement bicarbonaté) ou une perte d’acide (exemples: vomissements, carence potassique, élévation anormale du taux d’aldostérone sanguin).Le mécanisme compensateur est également pulmonaire par hypoventilation, qui tend à augmenter la pC2 artérielle: en fait, ce mécanisme est limité par l’anoxie qu’il provoque, entraînant une hyperventilation. La décompensation est donc plus rapide dans ce type de trouble.L’acidose gazeuse est provoquée par une élévation de la pC2 artérielle dont le type est l’hypercapnie aiguë, par dépression des centres respiratoires, mais aussi par obstruction des voies aériennes ou paralysie des muscles respiratoires (poliomyélite). La correction du trouble est rénale, par accroissement de la réabsorption des bicarbonates, de l’excrétion d’acidité titrable, de l’excrétion d’ions ammonium.L’alcalose gazeuse résulte d’une diminution de la pC2 artérielle par hyperventilation (exemples: anoxie des centres bulbaires, hypoxie par intoxication à l’oxyde de carbone, abaissement de la pC2 alvéolaire dans le séjour en altitude élevée). La correction est rénale par diminution de la réabsorption rénale des bicarbonates, de l’excrétion d’acidité titrable, de l’excrétion d’ions ammonium.En fait, les troubles mixtes sont extrêmement fréquents (exemples: insuffisance rénale chez un insuffisant respiratoire chronique, troubles respiratoires aigus chez les insuffisants rénaux). Dans tous les cas, les mécanismes compensateurs peuvent être vite débordés, les modifications du pH devenant patentes, voire mortelles, si elles dépassent les limites compatibles avec le maintien de la vie cellulaire.Un fait doit être souligné: il existe une tendance physiologique à l’acidose métabolique par accumulation d’acides non volatils, produits du métabolisme intermédiaire.Le rôle des tampons cellulaires commence à être entrevu: l’utilisation des mesures de pH cellulaire, associée à l’emploi des isotopes radioactifs pour la détermination des compartiments corporels, permettra de mieux comprendre leur rôle.
Encyclopédie Universelle. 2012.
